Syndrome CACH
Le syndrome VWM
Que se cache-t-il derrière le syndrome CACH ?
Article revu par le Pr. Nicole Wolf
Le syndrome de CACH, tient son nom de l’anglais Childhood Ataxia with Central nervous system Hypomyelination qui signifie Ataxie infantile avec hypomyélinisation diffuse du système nerveux central. Il lui est préféré aujourd’hui le nom de leucoencéphalopathie avec perte de substance blanche (leukoencephalopathy with Vanishing White Matter en anglais, VWM). C’est une maladie génétique de la famille des leucodystrophies et bien qu’étant l’une des leucodystrophies les plus répandues, avec une prévalence d’environ 1 sur 80 000. Elle fait partie des leucodystrophies hypomyélinisantes secondaires à un endommagement des astrocytes. Le syndrome VWM présente une dégradation progressive de la substance blanche au niveau du cerveau.
Le syndrome VWM peut se manifester dès la petite enfance, souvent avant l’âge de 4 ans, mais certains patients ne présentent les premiers symptômes qu’à l’âge adulte. Ce syndrome se caractérise par différentes caractéristiques neurologiques, dont l’ataxie cérébelleuse progressive, la spasticité, et les troubles cognitifs associés à des lésions de la substance blanche visible par imagerie cérébrale.
• L’ataxie cérébelleuse progressive est un trouble progressif de la coordination. La spasticité est un étirement rapide d’un muscle qui entraîne une contraction réflexe, qui se traduit par une raideur musculaire, des spasmes ou des contractures. Les troubles cognitifs regroupent les troubles de la mémoire, de la perception, le ralentissement de la pensée et les difficultés à résoudre des problèmes.
Les patients ont généralement un développement précoce normal, suivi d’une détérioration neurologique chronique et d’épisodes de déclin rapide provoqués par le stress. Aucun traitement n’est disponible à ce jour.
Cinq gènes ont été identifiés comme pouvant porter des mutations entrainant le syndrome VWM. Ce sont les gènes des facteurs d’initiation eucaryotes ou EIF2B1 à 5 qui sont situés sur différents chromosomes. Ces gènes codent chacun pour une protéine impliquée dans l’initiation de la traduction, c’est-à-dire dans la fabrication des protéines.
Les symptômes de la maladie
Bien que le syndrome VWM ait été initialement reconnu comme un trouble chez les jeunes enfants, on sait aujourd’hui que l’apparition et la gravité de la maladie varient considérablement, d’une maladie prénatale ou infantile précoce progressant rapidement, à une maladie de l’adulte de progression plus lente. Le syndrome entraine généralement une ataxie, de la spasticité, et une atrophie optique variable.
Les formes de la maladie
Chez l’enfant, la maladie apparait le plus souvent avant l’âge de 4 ans sous la forme de problèmes moteurs, en particulier dans la démarche. L’apparition prénatale peut se caractériser par un retard de croissance intra-utérin, un petit volume de liquide amniotique, des mouvements fœtaux réduits et / ou des contractures à la naissance. Après la naissance, ces enfants présentent souvent des signes d’encéphalopathie, avec irritabilité, somnolence et convulsions. D’autres organes comme le foie peuvent être atteint aussi dans ces formes précoces.
Chez l’adolescent et l’adulte en revanche, il est fréquent que la maladie se déclare par l’apparition de problèmes cognitifs ou psychiatriques, mais la perte de la motricité acquise est fréquente.
Le diagnostic de la maladie
Environ la moitié des patients présentent un premier signe de la maladie après un événement déclencheur, comme une infection ou un traumatisme crânien.
Les 3 premiers cas ont été décrits en 1993. Depuis 1997, 4 critères diagnostiques ont été proposés:
• 1. le développement moteur et mental initial est normal ou légèrement en retard;
• 2. la détérioration neurologique suit une évolution chronique progressive et épisodique, et les épisodes de détérioration peuvent apparaitre à la suite d’une infection mineure et d’un traumatisme crânien mineur, et peuvent entraîner une léthargie ou un coma;
• 3. les signes neurologiques consistent principalement en une ataxie cérébelleuse et une spasticité; l’atrophie optique peut se développer plus tard, mais n’est pas obligatoire; l’épilepsie peut survenir, mais n’est pas le signe prédominant de la maladie; les capacités mentales peuvent également être affectées, mais pas au même degré que les fonctions motrices.
• 4. l’IRM présente des caractéristiques de la leucoencéphalopathie VWM reconnaissables par les experts.
La spectroscopie par résonance magnétique peut être utilisée pour obtenir des preuves supplémentaires pour le diagnostic. Les spectres de substance blanche montrent une diminution grave, ou une disparition presque complète de tous les signaux normaux, et une faible présence de lactate et de glucose.
Lorsque la suspicion clinique est élevée, le diagnostic de VWM est confirmé par des tests génétiques sur les 5 gènes codant les cinq sous-unités eIF2B, et des variants homozygotes ou hétérozygotes sont recherchés.
Le mécanisme simplifié conduisant à la maladie
L’identification des 5 gènes responsables de ce syndrome a permis de mieux comprendre ce qui constitue le phénotype clinique de la maladie et de mieux comprendre la physiopathologie, c’est-à-dire les troubles moléculaires et cellulaires responsables du syndrome.
Pour aller plus loin…
Rien ne sert de courir, il faut partir à point !
Dans les cellules, toute une industrie est responsable de la fabrication des protéines. Et pour le syndrome VWM, comme pour d’autres leucodystrophies (voir ELA info 103 : LTBL), ce sont des molécules impliquées dans la fabrication des protéines qui sont différentes chez les patients, et plus précisément des molécules jouant un rôle essentiel dans l’initiation de la traduction, c’est-à-dire les premières étapes de la fabrication.
Zoom sur eIF2B :
eIF2B est lui-même un assemblage de plusieurs molécules, celles fabriquées par les cinq gènes dont les variants génétiques sont à l’origine du syndrome VWM.

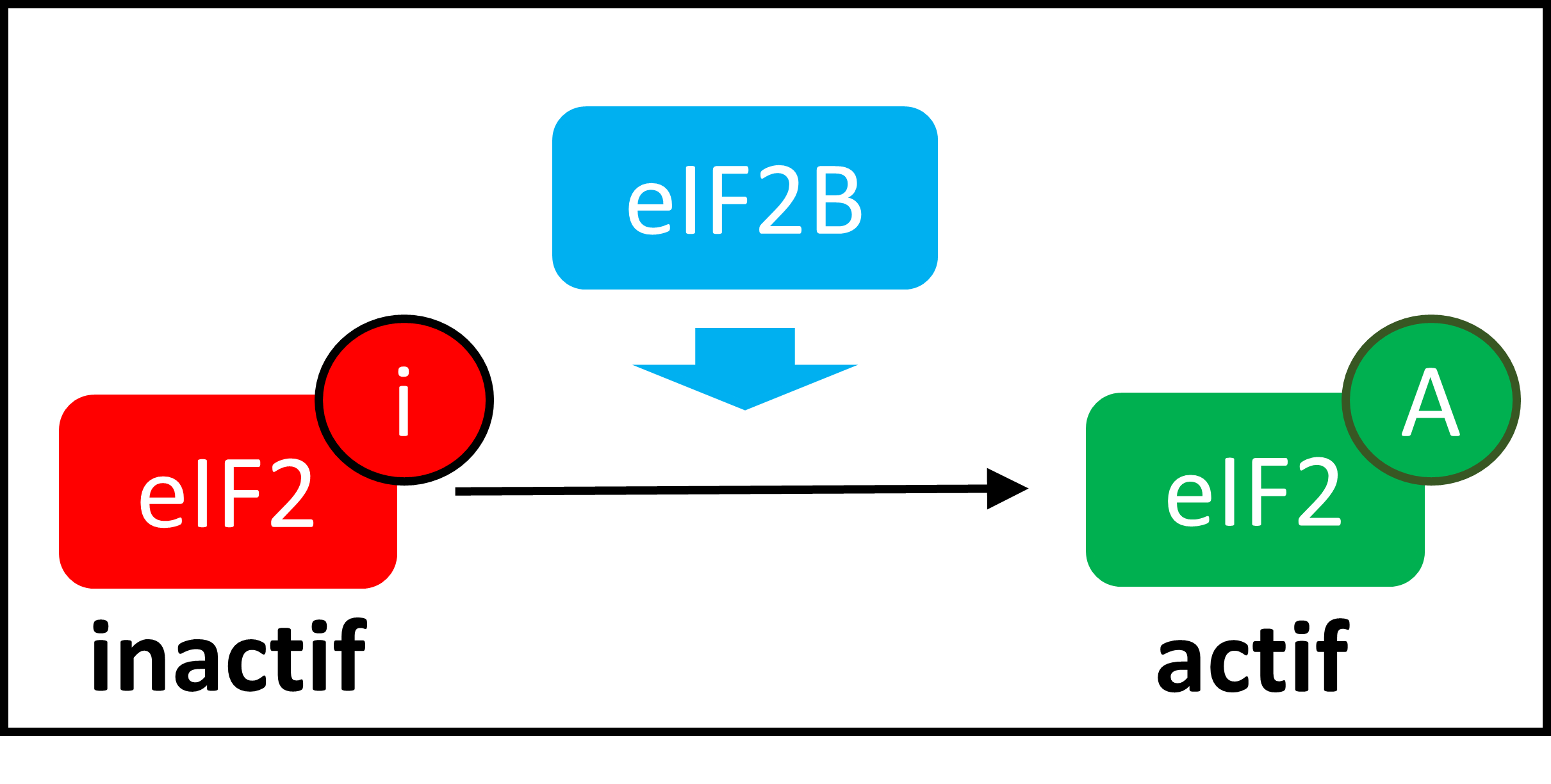
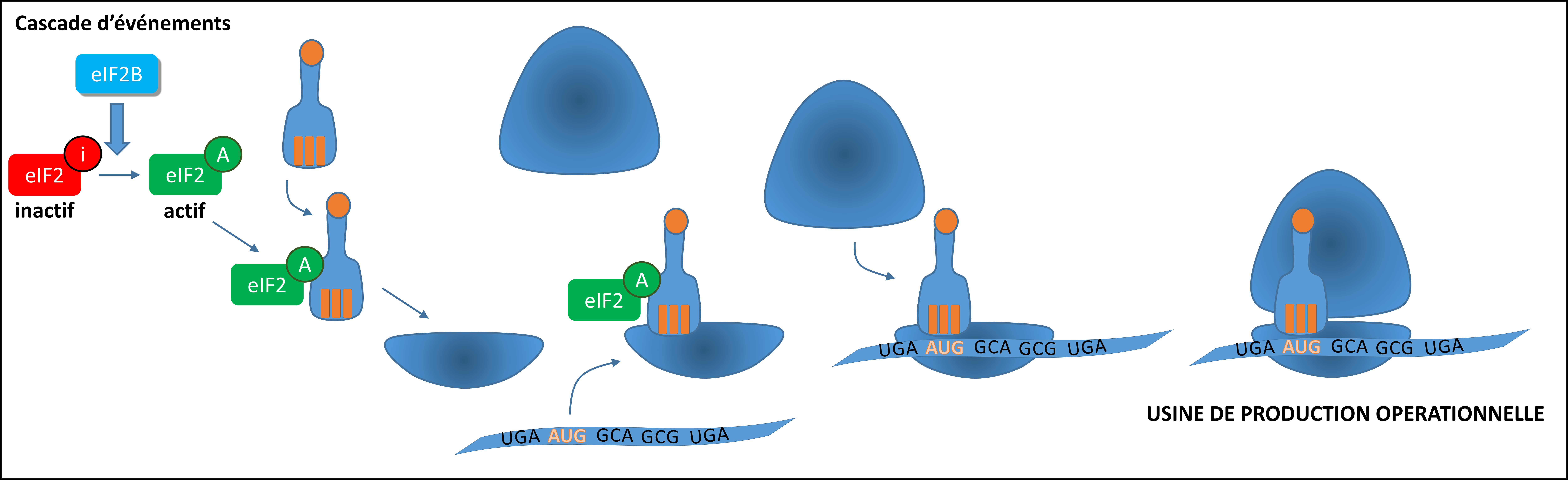
Pour permettre cette première étape limitante dans la fabrication des protéines, une cascade d’événements va conduire à l’assemblage d’un ensemble de molécules, le complexe d’initiation (correspondant à une usine de production). Le complexe eIF2B est responsable d’activer la formation du complexe d’initiation de la traduction, en activant eIF2 :
La traduction : fabriquer des protéines
Le complexe d’initiation de la traduction eIF2B est nécessaire à la traduction normale des protéines. Les variants génétiques à l’origine du syndrome VWM provoquent une réduction partielle de l’activité de ce complexe.
Les cinq gènes du complexe eIF2B sont impliqués dans la réponse des cellules au stress. L’objectif est de rétablir la cellule en se concentrant sur la production d’éléments de réparation de la cellule. Les patients atteints du syndrome VWM ont une susceptibilité accrue de la substance blanche au stress cellulaire.
Pour aller plus loin…
Quand les choses se compliquent :
L’autre grande fonction d’eIF2B est la régulation de la réponse intégrée au stress (ISR). En cas de stress cellulaire, un signal d’alarme est tiré par la cellule pour ralentir la chaine de fabrication des protéines et permettre à la cellule de remettre les choses en ordre. La cellule va ne fabriquer que les protéines utiles à la remise en ordre de la cellule.
Les cinq gènes codant chacun une des sous-unités du complexe eIF2B ont une influence sur la synthèse protéique en cas de stress cellulaire. Leur mutation entraine un trouble de la maturation des astrocytes, ces cellules de la substance blanche associées aux neurones, et provoque une susceptibilité accrue de la substance blanche au stress cellulaire. Il est donc envisagé par les médecins d’essayer d’améliorer la réponse de ces cellules au stress, en favorisant la voie ISR.
Quand la voie ISR est activée, la phosphorylation d’eIF2 sur sa petite sous-unité, nommée « alpha », transforme eIF2. Au lieu d’être activé par eIF2B, eIF2 devient un inhibiteur compétitif d’eIF2B, ce qui veut dire qu’il empêche la formation du complexe d’initiation de la traduction et inhibe la synthèse globale des protéines. L’objectif est de rétablir la cellule en se concentrant sur la production d’éléments de réparation de la cellule.
Les traitements
La prise en charge de la maladie au quotidien
La qualité de vie et le confort des patients peuvent être améliorés par une prise en charge des symptômes de la maladie. La plupart des patients présentent des crises neurologiques occasionnelles, qui, le plus souvent, peuvent être bien contrôlées avec des médicaments. Il est important de contrôler ces crises et de prendre des mesures préventives contre le traumatisme crânien, et d’éviter les antibiotiques et les traitements contre la fièvre (antipyrétiques).
Essai clinique
Le guanabenz est un antihypertenseur connu de longue date par les médecins, qui cible également la réponse au stress cellulaire.

Le traitement de souris ayant une leucoencéphalopathie avec perte de substance blanche, avec du guanabenz pendant 8 mois, a montré une amélioration des paramètres de la substance blanche. Ces travaux précliniques ont permis d’envisager aujourd’hui le premier essai clinique chez des patients atteints du syndrome VWM. Le guanabenz étant un médicament ancien et sûr, le premier essai clinique est en préparation en partenariat avec ELA. Cet essai va inclure une quinzaine d’enfants afin d’établir la dose optimale, établir la sécurité du médicament chez ces enfants, et mesurer l’évolution de leurs capacités motrices et cognitives sur une période de deux ans.
ELA accompagne les cliniciens et les chercheurs travaillant sur la leucoencéphalopathie avec perte de substance blanche. Les recherches doivent continuer pour améliorer la compréhension de la pathogenèse de la maladie, pour développer des traitements spécifiques et, idéalement, identifier un remède. Avec un premier essai clinique aujourd’hui, c’est l’espoir de voir la vie des patients s’améliorer demain.