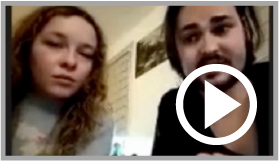
ELA international donne la parole aux parents des enfants malades qui s’élèvent contre l’interruption programmée d’un traitement en cours d’évaluation
Arrêt programmé en 2024
En 2012, la société Takeda démarrait un essai clinique pour évaluer l’efficacité d’une thérapie par enzyme de substitution (molécule TAK-611) dans la leucodystrophie métachromatique (MLD). A l’automne 2023, Takeda annonce que l’essai clinique en cours n’a pas atteint les objectifs de la phase 2, basés essentiellement sur l’évaluation des fonctions motrices des patients. La conséquence majeure de cette déclaration est l’arrêt du développement et de la production de la molécule TAK-611. Les associations et les médecins investigateurs sont informés par le laboratoire, charge à eux de l’expliquer aux familles.
ELA International recueille les témoignages des parents d’enfants malades, et celui des associations *
Le 4 décembre 2023, ELA International organise une réunion avec les familles concernées afin de collecter leurs observations et avis à propos du traitement. Au début de l’année 2024, ELA international poursuit sa collecte de témoignages provenant de différents pays à travers le monde : Allemagne, Argentine, Brésil, Espagne, États-Unis, France, Japon, Pologne. Les parents ont pu exprimer leur ressenti et donner leur avis sur les effets qu’ils ont pu noter sur la qualité de vie de leurs enfants. Tous sont unanimes, ils s’accordent pour dire que leurs enfants souffrent beaucoup moins, sont plus apaisés, plus souriants, plus interactifs et ont des activités sociales, en comparaison avec des enfants non traités.
ELA International interpelle le président de la société Takeda
Un document compilant tous ces témoignages est transmis par ELA International au président de la société Takeda. Il est accompagné d’une lettre demandant la prise en considération des observations faites par les familles et la reprise du développement du traitement avec une évaluation clinique sur la qualité de vie des patients atteints de MLD.
Takeda sensible à la voix des patients
Le 18 mars 2024, la société Takeda a répondu à toute la communauté MLD : elle a assuré que « Takeda a activement engagé des discussions et écouté les commentaires des investigateurs, des familles et de la communauté de défense des patients concernant le programme. » Les responsables de Takeda ont clairement entendu que « les familles des enfants participants aux essais désiraient sincèrement continuer à recevoir le TAK-611 ».
Ainsi, la société Takeda a « pris la décision de prolonger les études cliniques en cours sur le TAK-611 jusqu’à nouvel ordre. Cette prolongation des études cliniques comprendra la fourniture continue de TAK-611 aux sites d’essais existants. Elle permettra également aux patients et aux sites investigateurs de maintenir leur suivi actuel ». De plus, la société travaille « à déterminer une option plus durable et à long terme en coordination avec les autorités réglementaires compétentes. » ELA international tient à remercier Takeda pour son écoute et son retour positif, et s’engage à soutenir toute initiative prise dans l’intérêt des patients.
* Avec le soutien des associations : ELA France, ELA Espagne ; ELA Allemagne ; ELA Italie ; ELA Suisse ; ELA Belgique ; ELA Luxembourg ; archangel ; Casa Hunter Institution ; Cure MLD ; Fundacion Lautaro te necesita ; MLD foundation ; MLD support UK ; ULF pour leur investissement.